この記事は現在、プロジェクトメンバーによる査読中のものです。草稿段階ですので、内容・表現の正確さについて責任を負いかねます。
リンクを正しく張れていないところが存在しますのでご注意ください。
正式公開まで、いましばらくお待ちください。
エントロピー増大の法則を見てみる
熱力学で熱力学第二法則.つまり,エントロピー増大の法則を考える時,私は最初気体の入った箱を一つしか考えませんでした.エントロピー増大の法則は,「複数の」相互作用がある系を考えた時,その変化によって系全体のエントロピーが大きくなる方向に変化が起こるということを言っている法則です.系が一つでは分かるわけがないのです…….皆さんは,こんなところでつまづかないでくださいね^^.今回は,二つの系が相互作用している例でエントロピーの増加量を考えてみようと思います.理想気体で考えます. (2020.6.28追記:「りけいじん」さんと言う方に以前この記事の間違いをご指摘いただきました.その方がもう少し詳しくこの記事の内容を掘り下げて下さっているので,ご紹介させていただきます. 理想気体のエントロピー変化を計算計算してみる )
準備
まず,一分子あたりの定積比熱を 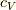 とします.普通のnモルあたり定積比熱とは
とします.普通のnモルあたり定積比熱とは 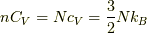 の関係があります.エントロピーの系の変化に対する影響がどうなるか,簡単に書いておきます.
の関係があります.エントロピーの系の変化に対する影響がどうなるか,簡単に書いておきます.
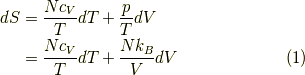
状態「0」からの変化を積分してもとめると,
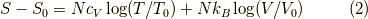
ここで体積を2倍にしてみると, 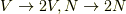 ですから,
右辺第二項は
ですから,
右辺第二項は 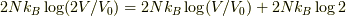 と
なり,エントロピーは示量変数ですから定数項
と
なり,エントロピーは示量変数ですから定数項 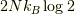 が出てくることで矛盾します.
そこで以下の様に修正がされます.
が出てくることで矛盾します.
そこで以下の様に修正がされます.
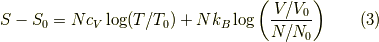
となります.これは熱力学の実験側からの修正で,後に統計力学で不可弁別性より説明されるようになったようです.
これから考える二部屋に「1」,「2」と名前を付けます.十分に時間が経って平衡状態に落ち着いた時の物理量をプライム(ダッシュ)  をつけて表すことにします.
また,部屋全体の量には,
をつけて表すことにします.
また,部屋全体の量には, 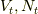 のようにトータル(total)の頭文字
のようにトータル(total)の頭文字 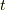 をつけます.基本的に式
をつけます.基本的に式 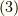 にある3つの変数
にある3つの変数 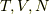 を求めて考えます.
を求めて考えます.
二部屋を仕切る透熱壁が固定されている系
まず,この場合エネルギー保存則より,
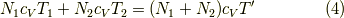
よって,
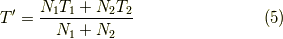
となります.そして, 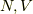 は変わりません.よって,エントロピー変化は,
は変わりません.よって,エントロピー変化は,
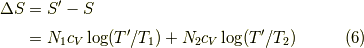
と求められます.
二部屋を仕切る透熱壁が可動な系
まず,この場合もエネルギー保存則より,
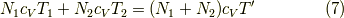
が成立します.
よって,
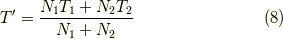
です.また,壁が可動なので,部屋1と2の圧力pは等しくなります.
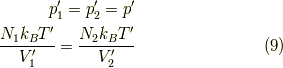
そして,変化の落ち着くところでは全体が一様になるので,これと状態方程式 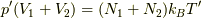 より,
より,
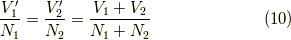
と, 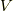 が求まります.そして,
が求まります.そして, 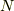 は変化しませんから,エントロピーは変化は,
は変化しませんから,エントロピーは変化は,
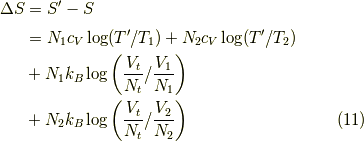
最後の二項が先ほどの結果式 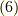 に比べて大きくなり,よりエントロピーが増大していると考えられます.
に比べて大きくなり,よりエントロピーが増大していると考えられます.
二部屋を仕切る断熱壁が可動な系
これは,左右の部屋の圧力が異なり,少し難しいです.思考実験をしてみましょう.理想気体の入った一部屋のピストンを断熱変化させることを考えます.
この時,押し方によって結果は変化します.仕事 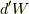 が変わってくるからです.今回考えたいのは,準静的な変化をする時です.
つまり,壁は断熱が完全で,移動速さは無限にゆっくりの時です.この時,定積比熱と定圧比熱の比熱比
が変わってくるからです.今回考えたいのは,準静的な変化をする時です.
つまり,壁は断熱が完全で,移動速さは無限にゆっくりの時です.この時,定積比熱と定圧比熱の比熱比 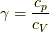 として,
として,

の関係があります.よって,上の変化をする限り,圧力は体積の関数となります.
二部屋の全体体積は 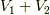 から変わりません.解く為の方程式は,
から変わりません.解く為の方程式は,
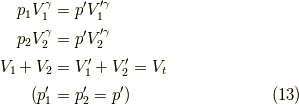
となります.未知量は 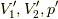 の三つですから,この3式は解けまして,少し変形して,
の三つですから,この3式は解けまして,少し変形して,
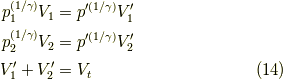
上の二式を足して,全体の体積( 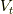 既知量)と関係づければよく,
既知量)と関係づければよく,
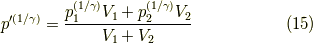
- と,
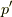 が求められました.これを式
が求められました.これを式 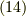 に戻せば,
に戻せば, 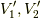 が求まります.
が求まります.
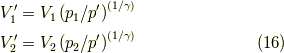
さらに,  について求めると,式
について求めると,式 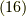 より,
より,
となります.また,式 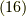 より,
より,
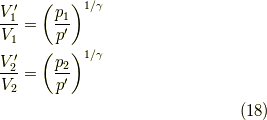
です.よって,変化後のエントロピー変化には,粒子数からの影響はない( 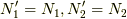 )ので,まず,系「1」のエントロピー変化を見てみると,
)ので,まず,系「1」のエントロピー変化を見てみると,
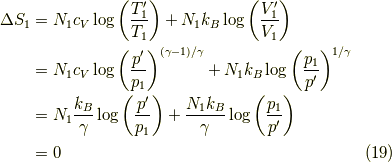
ここで,マイヤーの関係 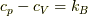 を使いました.系「2」も同様で,全体のエントロピー変化は,
を使いました.系「2」も同様で,全体のエントロピー変化は,

となります.この場合,エントロピーはどちらの部屋でも変わらず,全体としても変わりません. 「準静的な過程だからエントロピー変化がないです.また,このケースでは断熱壁を準静的に動かすには両部屋の圧力差を支える為,外部に仕事をしていることで,エネルギーが保存されてないことにも注意してください.」 というご指摘を読者様から頂きました.ありがとうございます.なるほど,確かに断熱過程なんだから,エントロピーは変化しないのですね.
今回は,すみませんが,エントロピー変化を求めることはできましたが,それが正の値をとるということまでは示せませんでした.今後それを示すうまい方法が見つかったら,追って証明しようと思います.今日はここまで.お疲れ様でした.