確認してもらえませんか?
確認してもらえませんか?
花鳥風月 さんの書込 (2009/08/15(Sat) 12:07)
お久しぶりでございます.
反応速度の問題をやっていて,答えが一致しません.どこがいけないのか見ていただけませんか?
問題 エタンの熱分解は一次反応であって,次のような各温度における反応速度定数を得た.これより,活性化エネルギーと頻度因子を求めよ. t(℃)550570590610630 k*10^5(/s)2.58.223.157.6141.5
僕のやり方 t=550℃と610℃に注目して, ln57.6 =lnA-E/883R ln2.5 =lnA-E/823R より,E=316kJとなりましたが, 解答では,301kJとなっています. どこがいけないのでしょうか?
Re: 確認してもらえませんか?
yama さんのレス (2009/08/15(Sat) 15:18)
用いるデータによって違いが生じると思います. 570℃と610℃の値を用いると301kJになるようです. 最も適切な方法は,すべてのデータを用いて最小自乗法によって最確値を求めることでしょうね.
Re: 確認してもらえませんか?
花鳥風月 さんのレス (2009/08/15(Sat) 17:34)
選ぶデータによって誤差が生じていたのですね. 最小二乗法かあ.なかなか大変ですね,,,. 有難うございます.直接の疑問は解決できました.
Re: 確認してもらえませんか?
komagatake さんのレス (2009/08/18(Tue) 07:52)
失礼します.
測定点が5つあります. どの値を使うかはまずグラフを書いてから決まることです.
ln(k)と1/T で書くと直線になるはずの式です. 書いてみると少し上に湾曲しています. 最小自乗法を使うかどうかは別にして直線に載っていることの確認は必要です. 両端の値を使うと頭から決めてしまうのは間違いです. 2番目と4番目を使うというのはグラフを書いてみての選択です.
最初のデータの2.5という数字が精度不足であるということから外すという判断も成り立ちます.
Re: 確認してもらえませんか?
toorisugari no Hiro さんのレス (2009/08/18(Tue) 10:08)
この程度のデータ数だと判断は難しいですね. 機械的に最小二乗法で計算すると
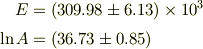
となり,
> より,E=316kJとなりましたが,解答では,301kJとなっています.
花鳥風月さんの方がぎりぎりレンジ内です.(別に最小二乗法が正しいという意味ではありません.)
そもそも,これはfactor 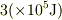 が合えば十分(せいぜい有効数字2桁
が合えば十分(せいぜい有効数字2桁 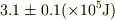 )といった精度の問題だと思います.
)といった精度の問題だと思います.