分子の速度,慣性モーメント
分子の速度,慣性モーメント
digi さんの書込 (2008/07/12(Sat) 03:28)
(1)温度がおなじとき,水素分子の平均の速さは窒素分子の何倍か?
(2)球殻の慣性モーメントはどうやって求めるのでしょうか?
関連性のない質問で申し訳ありません. (1)は答えが√7となっているのですが,どう計算しても√14にしかなりません.
Re: 分子の速度,慣性モーメント
mNeji さんのレス (2008/07/12(Sat) 12:56)
digiさん,
(1) どのような式を元にそのように考えたかを示されると,コメント出来るとおもいます.
(2) 球殻を《「球殻の外径と等しい外径の球」ー「球殻の内径と等しい外径の球」》と考えるとどうですか.
Re: 分子の速度,慣性モーメント
digi さんのレス (2008/07/12(Sat) 23:40)
(1)についてですが,分子の平均の速さは
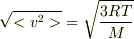 で表わされますよね?(Mは気体の分子量,Rは気体定数,Tは温度)
求める値は
で表わされますよね?(Mは気体の分子量,Rは気体定数,Tは温度)
求める値は
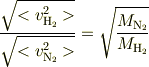
となり,水素の分子量は2,窒素の分子量は28と考えて,答えは√14としました.
(2)は,半径a,質量Mのピンポン玉の慣性モーメントを求めるもので,球殻の厚さは無視するものとすればどうすればいいでしょうか?《「球殻の外径と等しい外径の球」ー「球殻の内径と等しい外径の球」》では0になる気がするのですが?
Re: 分子の速度,慣性モーメント
mNeji さんのレス (2008/07/13(Sun) 00:28)
(1) ああ,そうですね.原子番号と原子量とを勘違いしていました.お説で正しいと思います.
(2) ということは,面密度から定義に従って計算するしか無いように思います.球殻の中心を原点として,z軸について回転させると考えて慣性能率を定義に従って計算するのはどうですか?
Re: 分子の速度,慣性モーメント
mNeji さんのレス (2008/07/13(Sun) 11:09)
(2)に付いて補足
「球慣性モーメント」で検索すると;
一様な球の慣性モーメント
というサイトを拝見出来ました.此処では球の慣性能率を密度と半径の関数として表現してあります;
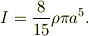
今,密度一定として, 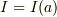 と考えます.すると,半径a〜a+δの薄い球殻の慣性能率をΔIとしますと;
と考えます.すると,半径a〜a+δの薄い球殻の慣性能率をΔIとしますと;
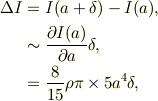
となります.いま薄い球殻の質量をMとすると;
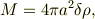
の関係から, 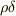 を消去すれば,薄い球殻の慣性能率を求める事ができますね.
を消去すれば,薄い球殻の慣性能率を求める事ができますね.
Re: 分子の速度,慣性モーメント
komagatake さんのレス (2008/07/15(Tue) 13:01)
慣性モーメントについての質問は多いですね. 分かりにくいようです.
結局,意味が分からなくて公式に頼る事になってしまうからでしょう. 面倒な積分の計算だけになります.
普通は剛体の回転についての運動方程式 Idω/dt=N で定義されています.どれもなじめない量です.
私は運動エネルギーで考えるのがいいのではないかと思っています. 自分で変形できますので公式に頼る度合いが少なくなります.イメージも取りやすいです.
半径rの円周上を角速度ωで運動している質量mの質点を考えます. 速さv=rω 運動エネルギー=(1/2)mv^2=(1/2)m(rω)^2 です.どちらの表現でも同じです.
質量が分布していればどうなるでしょうか. 基本的には各部分についての重ね合わせで考える事になります. その場合,vの式ではなくてωの方の式を使います.ωが全体で1つ決まっていてもvは各場所によって変わります.rが変わるからです. 質量が分布している剛体に対してはvを使うことが出来ません.
運動エネルギーを (1/2)Iω^2 と表します.このIが慣性モーメントです. 質点の場合I=mr^2です.質量が分布していてもrが同じであれば同じ式です.mは全質量の意味になります.亜鈴型や円環もこの場合に当てはまります.
※円環の場合は面倒な計算なしで求まリます.積分は必要ありません. ※普通の力学の教科書では,棒,直方体,円板,球,・・・と進むようです.円環とか,球殻は円板,球の微分で考えるという立場からか後回しになっています.
半径がrの円板は円環の重ね合わせです. (難しくありませんからやってみてください.)
半径の小さい所にも質量が分布していますから運動エネルギーは (1/2)m(rω)^2よりも小さくなります. I=αmr^2でα<1です. これは半径が(√α)rの円環に全ての質量が分布している場合と同じだということです.(√α)rは回転のエネルギーについての有効半径だと考えていいでしょう.慣性モーメントの計算はこのαを求めるものです.この同じIが回転のトルクを考える時にも出てくるのです.
円板についての計算の結果はα=1/2ですから有効半径はr/√2≒0.7rです.半径が0.7rの円環上に全質量のある回転と同じだということになります.
球殻も円環の重ねあわせで考えることが出来ます.今度はα=3/4です.1/√2よりも少し大きいです.回転半径が球の半径に近い所のウエイトが大きいということになります.半径=r,高さ=rの円筒(缶詰の缶のような形)の回転と半径rの球殻の回転とが同じになると言うともっとイメージが取れるのではないでしょうか.
Re: 分子の速度,慣性モーメント
digi さんのレス (2008/07/17(Thu) 02:01)
詳しいご説明ありがとうございます.慣性モーメントについては考えてみます.
分子の速度のほうなのですが,結局正しい答えは√14でいいのでしょうか?解答は√7ですが.
Re: 分子の速度,慣性モーメント
mNeji さんのレス (2008/07/17(Thu) 02:26)
>分子の速度のほうなのですが,結局正しい答えは√14でいいのでしょうか?解答は√7ですが.
水素分子 vs 窒素分子ならば√14でいいと思います.もしヘリウム原子 vs 窒素分子ならば√7ですが,不自然ですね.あ,重水素分子なら√7ですね.
それとも窒素分子に特別な運動モードがあるとか?もし識者の方がいらっしゃれば,コメントを頂けないでしょうか.
Re: 分子の速度,慣性モーメント
komagatake さんのレス (2008/07/18(Fri) 09:00)
私も√(14)だと思います.
比熱の場合はエネルギーが配分される自由度が併進の自由度以外にあるかどうかが問題になります.でも今は併進の自由度について異なる物質での比較です.
周囲から力を受けていない場合,重心の併進運動と重心周りの回転とは常温で十分に励起しています(動き回っているのですから当然です).1自由度当たり(1/2)kTという等配分則が成り立っています.
参考までに比熱の値を載せておきます. 2原子分子のモル定積比熱Cvは(5/2)RT,モル定圧比熱Cpは(7/2)RTですから比熱比は γ=7/5=1.4 です.理科年表の古い版(2008年版では削除されています)にはこの値が載っています. H2γ=1.404(100℃) N2γ=1.402(100℃)
この値は温度が低くなるとやや大きくなります. H2γ=1.410(0℃) N2γ=1.405(16℃)
Cp=Cv+Rですから,γが大きくなったということはCv,Cpが小さくなっているということです.これは自由回転が少し制限されているのだろうと思います.でもごくわずかです.
とにかく√7か√14かというレベルではありません.
※理科年表にはcpが載っています.なぜかモル定圧比熱ではなくて1gあたりです.換算が面倒なのでγを使いました.
Re: 分子の速度,慣性モーメント
mNeji さんのレス (2008/07/19(Sat) 13:56)
komagatakeさん,
>比熱の場合はエネルギーが配分される自由度が併進の自由度以外にあるかどうかが問題になります.でも今は併進の自由度について異なる物質での比較です.
なるほど,そうですね.重心の並進運動と相対運動とをごちゃ混ぜにしていたようです.ご説明,有り難うございました.