物理化学?
物理化学?
あやこ さんの書込 (2007/05/16(Wed) 21:45)
外部に熱の移動はないとして4^m*4^m*3^mの部屋の空気の温度を10度から25度まで温めるのに要する熱エネルギーはいくらか教えてください. お願いします.
Re: 物理化学?
komagatake さんのレス (2007/05/17(Thu) 05:49)
ヒントだけにします.
比熱が必要ですね. 気体の場合は比熱が2つあります.体積一定の場合の定積比熱,圧力一定の場合の定圧比熱です.この場合は定積比熱ですね.
空気を2原子分子理想気体とします. 1モル当たりの定積比熱が(5/2)R,定積比熱が(7/2)Rです. Rは気体定数です. ※1原子分子だと(3/2)Rと(5/2)Rになります.差がRです.
これでいけると思います.
Re: 物理化学?
あやこ さんのレス (2007/05/17(Thu) 07:23)
1モルあたりの定積比熱はどのようにして求めるのでしょうか? また,N2とO2の比が2対8というのは関係ないとみなせるのでしょうか? また,調べたのですが,求まった比熱を何の式に代入すればいいのかわかりません.お願いします.
Re: 物理化学?
komagatake さんのレス (2007/05/17(Thu) 10:04)
高校で理想気体というのを習いませんでしたか.
O2,N2は共に2原子分子です.違いは出てきません.元々ボイルの法則とかシャルルの法則とかはまず空気について行われた実験です.
比熱さえ分かれば水の温度を上げるときに必要な熱量の考え方も同じです.
Rの値はご存知ですね.単位に注意が必要です.J/K・molにして使います. 1モルの体積も分かりますね.
でも問題文の中には圧力が示されていませんので条件が不足しています.
Re: 物理化学?
komagatake さんのレス (2007/05/17(Thu) 11:01)
>1モルあたりの定積比熱はどのようにして求めるのでしょうか?
これは(3/2)Rをどの様にして導くのかという意味ですか.
内部エネルギーの増加は ΔE=Q+W です.Qは外部から加えられた熱量です.Wは外部からされた仕事ですので体積変化をΔVとしますとW=−PΔVとなります. 比熱はQ/ΔTですので 定積比熱Cv=ΔE/ΔT 定圧比熱Cp=ΔE/ΔT+PΔV/ΔT=Cv+PΔV/ΔT です. 圧力一定の時は PΔV/ΔT=Δ(PV)/ΔT=Δ(RT)/ΔT=R です. 1原子分子の場合,E=3RT/2は気体分子運動論から出します.この式を1自由度当たりRT/2と読んでエネルギー等配分則を導きます.2原子分子の場合原子間距離が変わらないという仮定で自由度を5とするとE=5RT/2が出てきます. Cv=ΔE/ΔT=5R/2となります.
ここまでは高等学校の教科書に載っています. (「エネルギー等配分則」という言葉は出てこないと思います.むしろ温度がうんどうエネルギーの尺度になっているということにウエイトがあるようです.)
2原子分子の伸縮振動はもっと高い温度での励起になりますので通常の温度では結合距離が変わらないと考えています.分子によって起こりやすさに差がありますので比熱の実測値は5R/2から少しずれます.
Re: 物理化学?
なんとなく さんのレス (2007/05/17(Thu) 13:26)
こんにちは. 横やりすみません. 余計なことかも知れませんが,かなり初等的なところでつまずいているように見受けられます.本当に余計なら,以下は無視してください. 問題の意図する前提条件にはkomagatakeさんの言われるように圧力(気圧)が不足しています.部屋なので1気圧(標準大気圧)とするのでしょう. すると,この問題はどのような道筋で考えればよいのか,例を示しますので,参考にしてください. 部屋には空気があって,酸素や窒素があるでしょうが,まあ,理想気体と見なすのでしょう.理想気体で考える場合,1モル(分子量)は空気の分子量に換算する必要がありますが,体積なら差が無いですね.理想気体は暗黙に,0℃1気圧で1モルが22.4リットルを占めるというお約束ですが,今は10℃ですから,この部屋4×4×3(m3)の空気は何モルあるか計算できます. 部屋に空気や熱の出入りが無いとすると,体積一定ですから,定積モル比熱を使えば必要な熱量が計算できそうです.定積モル比熱は1モルの気体を体積一定で1°K上げるのに必要な熱量ですから,上記モル数分,25-10=15(°K)上げるのは? ここで,温度でモル数は変化しないことを使っています. そんなことは分かっている!ということなら,失礼しました.
Re: 物理化学?
yama さんのレス (2007/05/17(Thu) 14:56)
部屋が密閉されていれば,モル数は変わりませんが,実際には窓や扉には隙間があって空気が出入りし,外部の気圧に等しくなるのではないでしょうか. その場合は,体積と圧力が一定でモル数が変化することになりますね. しかしそうなると問題が難しくなるので,気密室のようなものが想定されているのかもしれません. 両方の場合を考えてみるのもいいと思います.
Re: 物理化学?
あやこ さんのレス (2007/05/17(Thu) 15:53)
皆さんありがとうございます.皆さんのヒントをもとに自分なりに考えてみました.間違っていたら指摘していただけるとうれしいです. 1アトム,10℃と想定して n=[1atm*48m3]/[8.31*10-3乗(m3・atm/K・mol)*(273+10)(K)]=20.41mol Cv=5/2R=20.78(J・K-1・mol-1) 求める値を?Uとすると?T=15Kより ?U=20.41*20.78*15=6361.797(J)
Re: 物理化学?
komagatake さんのレス (2007/05/17(Thu) 19:09)
あやこさん
>n=[1atm*48m3]/[8.31*10-3乗(m3・atm/K・mol)*(273+10)(K)]=20.41mol >Cv=5/2R=20.78(J・K-1・mol-1)
2行目でR=8.31J/K・molを使っています. 1行目での値がこの値を換算したものになっていません. 桁が違っています.
概算をしてみると間違いが分かります.状態方程式に振り回されるといけません. 1atm,10℃で48m^3の空気ですね.273Kと283Kはあまり違いはありません.48×10^3/22.4と近いはずです.これは2000のオーダーです.100倍違ってきています.
Re: 物理化学?
あやこ さんのレス (2007/05/17(Thu) 20:09)
>2行目でR=8.31J/K・molを使っています. 1行目での値がこの値を換算したものになっていません. 桁が違っています.
n=[1atm*48m3]/[8.21*10-2乗(dm3・atm/K・mol)*(273+10)(K)]とし, dは10の-1乗だから,n=2065.91molとすればよいのでしょうか?お願いします.
Re: 物理化学?
komagatake さんのレス (2007/05/17(Thu) 23:37)
いいと思います. ただこんなに桁数をたくさんにする必要はないと思います.2065.91は多すぎます.せいぜい2桁というところだと思います.最後の結果も同様です.
Re: 物理化学?
あやこ さんのレス (2007/05/18(Fri) 05:39)
わかりました.本当にありがとうございます!
Re: 物理化学?
komagatake さんのレス (2007/05/18(Fri) 15:37)
yamaさんからの宿題について
部屋から空気がもれてP一定になっている場合
難しいことは忘れましたので初等的に解いてみました. 間違っているかも知れません.
ピストンの付いたシリンダーの中に気体が入っているとします.温度,圧力,体積をT,P,Vとします.外部の圧力もPとします. PV=nRTです.
TをT’まで加熱します. (1)ピストンが固定されているとQ=nCv(T’−T)です. (2)ピストンが自由に動くことが出来るときはQ=nCp(T’−T)です.
(3)ピストンに穴があって中の空気が絶えず外の広い空間にもれているときは?
膨張がありますので定圧比熱が必要でしょうが(2)とは違います.出て行った空気はもう暖める必要がないので(2)より少なくなるはずです. そこで次のように考えました.二重のピストンを考えます.内側のピストンは固定されています.外側のピストンは自由に動くことが出来ます.内側のピストンにはには穴が空いています.はじめ2つのピストンは密着しています.温度を少し(δT)だけ上げると膨張して外のピストンが動きます.釣り合った状態での体積はV+δV=nR(T+δT)で決まります.この時の熱量はnCpδTです. ここでδVの空気を捨てます. 物質量はnV/(V+δV)=nT/(T+δT)に減ってしまいます.この空気の温度をまたδTだけ上げます.必要な熱量はnT/(T+δT)CpδTになります.これを繰り返して和を取ると必要な熱量になると思います.
T=283K,T’=298Kで1K刻みで和を取ると Q=nCp(T’−T)×0.88 となりました. Cv=Cp×(5/7)=Cp×0.71 ですからほぼ(1)と(2)の中間の値です.
これでいいでしょうか.
Re: 物理化学?
yama さんのレス (2007/05/18(Fri) 18:12)
考え方はいいと思いますが,計算結果は違っているように思います. 最終的に外部に出て行く空気量は初めの空気量の5%程度なので,少なく見積もっても Q=nCp(T’−T)×0,95 程度にはなるはずです.
きちんと計算すると
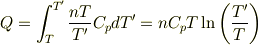
となりますが,これはほぼ Q=nCp(T’−T)×0,97 になると思います.
Re: 物理化学?
komagatake さんのレス (2007/05/18(Fri) 19:27)
yamaさん
私もはじめはlogの形になるのかなと思ってやり始めました.でも簡単な積分の形になりませんでした.
違いがどこにあるかの吟味がちょっと難しいのですがとにかく書いてみます.
No15928に1項目と2項目とを書きました.多分その次に違いがあると思います. 1項目nCpδT 2項目nT/(T+δT)CpδT 3項目nT^2/(T+δT)(T+2δT)CpδT 4項目nT^3/[(T+δT)(T+2δT)(T+3δT)CpδT ・・・・
お示しの積分はT/T’の形になっていますので違いがあります. これは各区切りごとに膨張した空気を捨てていくということでその分の加熱が不要になっている分熱量が少なくなっていると考えられます.
Q=nCp(T’−T)×0.95
について考えてみました.最終的に空気が5%減少したとしたときの見積もりです.
nCp(T’−T)は空気を全て加熱した時のものです.0.95をかけるということで最後に一度に捨てるということと同じだと見ていることになります.残った空気に相当する分の熱量を割合で求めています.捨てる部分にも熱を加えていることになっていますので必要な熱量が大きくなってしまったのではないでしょうか.
私の出した式は簡単な積分に直せませんでしたので和を求めました.
Re: 物理化学?
yama さんのレス (2007/05/18(Fri) 22:44)
3項目からが違っているように思います. 3項目は,2項目に (T+δT)/(T+2δT) を掛けたものになるので, nT/(T+2δT)CpδT になり,同様に4項目は nT/(T+3δT)CpδT になります. δTを限りなく小さくすると,これらの項の総和は前記の積分に等しくなります.
また,最終的には 95%程度すなわち物質量で 0.95n 程度の空気が残るわけです. この空気を一定圧力下で温度TからT’まで加熱するのに必要な熱量が Q=nCp(T’−T)×0,95 になるわけです.つまり,これは最終的に残る空気だけを加熱する場合の熱量なので,捨てられる空気を加熱する熱量は含まれていません. 実際には捨てられる空気も多少は加熱されるので,熱量はこれより多くなります. 「少なく見積もっても」この程度にはなるということです.