エントロピー計算
エントロピー計算
E3 2年生 さんの書込 (2006/08/02(Wed) 23:34)
テスト問題で以下の問題が出ました.
→次の各々の過程でのエントロピー変化はどれだけか?
質量400[g],比熱3/8[J/g・K],温度が373[K]の銅の塊を水温283[K]の湖の中に入れた場合.
?湖のエントロピーはどれだけ増加するか?
?銅のエントロピーはどれだけ減少するか?
?湖と銅の塊をあわせた系の全体のエントロピー変化はどれだけか?
注意:In(373/283)=0.276
という問題がでました.
気になった点は湖の質量がわかってなくても数字のみで答えを求める事ができるのでしょうか??
また初歩的なことかもしれませんが・・・logとInの違いがよくわからないのです・・・どなたか分かる方がいましたら教えていただけないでしょうか??よろしくおねがいします.
Re: エントロピー計算
mNeji さんのレス (2006/08/03(Thu) 01:57)
始めまして.
大雑把な考え方を述べます.
- 湖の温度T_1=283K は一定と考えるとおもいます.
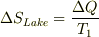
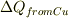
(2) 銅の塊の温度Tは熱を湖に伝えると温度がT_0=373KからT_1まで下がるとおもいます. 銅が温度Tの時の熱量Q(T)=CMT, C=比熱,M=重さ
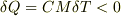
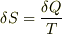 これをT_0からT_1まで足していくと.
これをT_0からT_1まで足していくと.
判らないところは?
Re: エントロピー計算
tadash さんのレス (2006/08/03(Thu) 02:49)
初めまして.
かぎしっぽのメンバーではないんですが・・・返信しても構わないんでしょうか?
銅の温度は373[K]と283[K]の間くらいに落ち着くのではないのでしょうか? それともT_1に下がるくらい湖が広いのですかね?
Re: エントロピー計算
mNeji さんのレス (2006/08/03(Thu) 03:49)
tadashさん:
始めまして.
私も6月後半から見に来るようになったのですが,誰でもが,質問も回答もOKだと思います.
>銅の温度は373[K]と283[K]の間くらいに落ち着くのではないのでしょうか? >それともT_1に下がるくらい湖が広いのですかね?
少なくとも,何かの仮定を持ってこないと,計算できませんね.恐らく,湖の熱容量が理想的に大きい,従って,理想的な温度一定の熱浴槽(heat bath とか言いませんでした?)と近似するのでは?
Re: エントロピー計算
mNeji さんのレス (2006/08/03(Thu) 20:51)
E3 2年生さん:
>T_1=一定で答えを導く事ができました
これは(1)の答えですよね?
(2)はどうなりましたか? また,logとlnの違いは判りましか?